Лекарства для борьбы с онкологическими заболеваниями должны не только избирательно поражать опухоль, но и обладать минимальным общетоксическим действием на организм. Российские ученые предложили изящный способ решения этой задачи, используя подход претаргетинга. Сначала новообразование «помечается» нетоксичным, безвредным для организма адресным компонентом, затем вводится высокотоксичный компонент, который, связываясь с предшественником, накапливается именно в месте опухоли. И все это благодаря «молекулярному клею», роль которого выполняют два природных белка — барназа и барстар. Результаты исследования, поддержанного грантом Российского научного фонда (РНФ), опубликованы в Journal of Controlled Release.
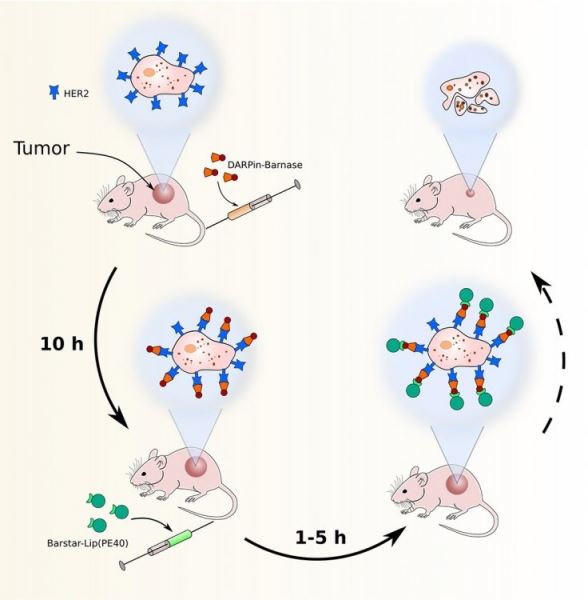
Схема эксперимента. Источник: Shramova et al. / Journal of Electroanalytical Chemistry
Согласно данным Всемирной организации здравоохранения, рак входит в десятку самых распространенных причин смерти в мире. Так, в 2020 году он привел к гибели десяти миллионов человек, поэтому активно разрабатываются новые способы борьбы с этим заболеванием. Препараты обычно содержат цитотоксичные соединения — вещества, которые останавливают рост и деление раковых клеток и вызывают их гибель. Сложность использования таких лекарств состоит в том, что они должны действовать точечно — только в месте образования опухоли, иначе разрушению подвергнутся здоровые клетки. На сегодняшний день на рынке фармпрепаратов существует большое количество лекарств, поражающих раковую опухоль, но, к сожалению, обладающих высокой общей токсичностью.
Исследователи из Института биоорганической химии имени академиков М.М. Шемякина и Ю.А. Овчинникова РАН (Москва), Института общей физики имени А.М. Прохорова РАН (Москва), Научно-исследовательского института морфологии человека (Москва), Томского политехнического университета (Томск) и Инженерно-физического института биомедицины (Москва) разработали новый метод ступенчатой доставки лекарств к опухолевым клеткам, который позволит снизить общетоксическое влияние противораковых препаратов. Ученые предложили использовать два бактериальных белка: фермент барназу и ее природный ингибитор (подавитель) барстар. Они очень быстро и прочно связываются друг с другом и могут служить в качестве «молекулярного клея», который позволяет соединять в живом организме нетоксичный адресный компонент, узнающий опухоль, и высокотоксичный компонент, который ее убивает. Чтобы эти два компонента встретились в организме, к каждому из них методами генной инженерии присоединили один из белков молекулярной пары — барназу или барстар. В качестве первого — адресного — компонента ученые использовали искусственно созданный белок, распознающий рецепторы клеток рака молочной железы. Этот белок был соединен с барназой. В качестве вещества, убивающего клетку, ученые использовали бактериальный токсин, заключенный в искусственные мембранные пузырьки — липосомы. Чтобы липосома могла найти барназу в организме и связаться с ней, на поверхность пузырька были прикреплены молекулы барстара.
Ученые протестировали разработанный метод на лабораторных мышах, которым прививались раковые опухоли человека. Сначала шестнадцати животным под кожу вводили клетки рака молочной железы. Через десять дней, когда опухоли начали расти, приступали к лечению. Для этого четырем мышам в брюшную полость вводили первый нацеливающий компонент, который «садился» на рецепторы раковых клеток. После того как первый компонент, который не связался с опухолью, естественным образом выводился из организма животного, вводили второй, цитотоксический. Два компонента прочно «склеивались» именно в месте опухоли, доставляя таким образом лекарство строго в нужное место. Процедуру повторяли ежедневно в течение десяти дней. В качестве группы контроля ученые использовали четырех мышей, которым вместо препаратов вводили плацебо, и восемь животных, получавших неполный набор компонентов: либо только первый, либо только второй из них.
Наблюдения за состоянием мышей и размерами их опухолей длились двадцать восемь дней с начала лечения. Оказалось, что у животных, которые получали плацебо или лишь одну часть препарата, опухоли увеличились в 3–5 раз и образовали метастазы. Напротив, у мышей, которые получали полную двухкомпонентную систему, размер новообразований уменьшился на 71%, и метастазов не наблюдалось. При этом гистологический анализ жизненно важных органов показал отсутствие их повреждений, а значит, и общей токсичности.
«В мире существует всего четыре системы предварительного нацеливания лекарства на опухоль. В основном они разработаны для радиотерапии, чтобы снизить лучевую нагрузку на организм пациента, но каждая из них имеет свои недостатки. Среди них можно отметить нежелательную активацию иммунного ответа, сложность и дороговизну производства. Компоненты разработанной нами системы — барназа и барстар — не имеют неспецифических мишеней в организме млекопитающих и поэтому обеспечивают высокую избирательность терапии. Кроме того, и барназу, и барстар методами генной инженерии можно легко соединить с любыми белками, распознающими любые онкомаркеры. В результате такой «молекулярный клей» становится удобной, надежной и универсальной системой предварительного нацеливания на самые разные опухоли и может лечь в основу разработки новых эффективных методов борьбы со злокачественными новообразованиями», — рассказывает руководитель проекта по гранту РНФ Сергей Деев, академик, доктор биологических наук, заведующий лабораторией молекулярной иммунологии Института биоорганической химии РАН.
Информация и фото предоставлены пресс-службой Российского научного фонда
Источник: scientificrussia.ru




